Entrevistas
Tomás Egaña: Luz verde en la regeneración de tejidos
Publicado 28-07-2015
- Millones de personas en el mundo sufren úlceras o lesiones que pueden tener una curación complicada por la falta de oxígeno, fundamental en el proceso regenerativo. Este investigador chileno ha desarrollado una esperanzadora tecnología: piel sintética que genera oxígeno por fotosíntesis.

Tomás Egaña Erazo es doctor en Biología Humana de la Universidad de Lübeck y doctor en Farmacología de la Universidad de Chile.
Tras una década en Alemania, el investigador Tomás Egaña (36) decidió volver a sus raíces, en un proceso de readaptación, que no le ha impedido trabajar en la batería de proyectos que se trajo en la maleta.
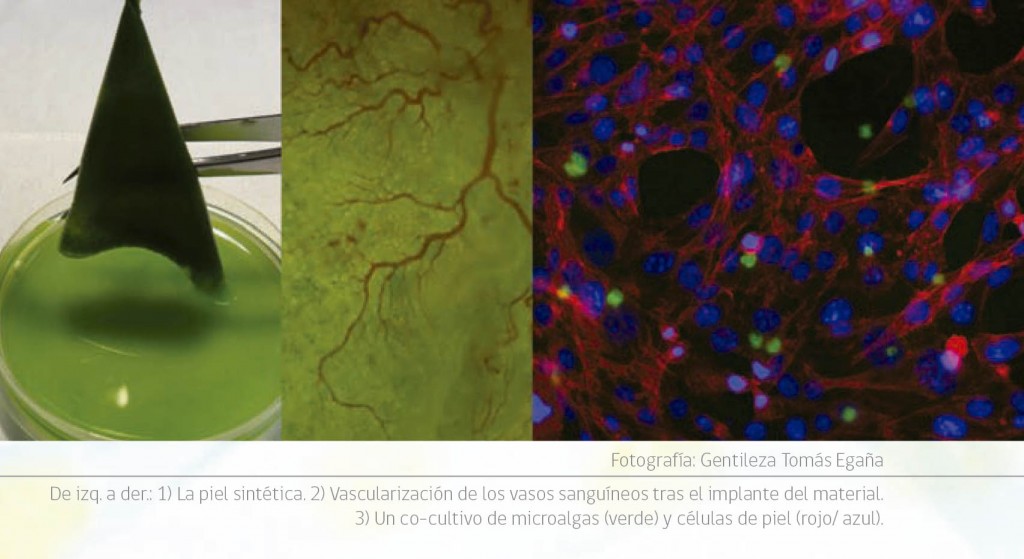
La mayoría de ellos están ligados a HULK, la piel fotosintética que nace de un proyecto de colaboración entre la Universidad Técnica de Múnich y el Centro Fondap de Regulación del Genoma, en Chile. “Es por las siglas en alemán”, explica con una sonrisa mientras exhibe una serie de fotos de una membrana verde y aspecto gelatinoso, “Hyperoxie Unter Licht Konditionierung” (Inducción de hiperoxia bajo condiciones de luz).
A diferencia de las pieles sintéticas utilizadas para tratar úlceras y heridas, este tejido es capaz de producir oxígeno en la zona afectada. Y el oxígeno es fundamental para el proceso regenerativo; su privación –conocida como hipoxia- puede afectar la recuperación de la herida y hacerla crónica.
“El oxígeno es mucho más que un nutriente”, puntualiza Egaña, “porque además cumple funciones de antibiótico, entre otras”. Entonces lanza la pregunta que puede interpretarse como el punto de partida: “¿Por qué, si es tan importante para nosotros, no tenemos mecanismos para producirlo, como las plantas?”
¿Y cuál es la respuesta?
Contamos con un sistema muy eficiente para transportar el oxígeno que nos rodea, que es el sistema cardiovascular. Entonces no necesitamos generarlo hasta que tenemos una herida, un infarto u otra condición que daña los vasos sanguíneos. En base a esto inventamos la ingeniería de tejidos fotosintética, cuya idea principal es generar un órgano artificial capaz de producir oxígeno como las plantas y que pueda vivir por un tiempo de la energía de la luz.
¿Cómo funciona?
Mezclamos biomateriales como colágeno y fibrina con microalgas que están en la naturaleza en este caso, Chlamydomonas reinhardtii, que se utiliza mucho en investigación. Cuando trasplantas esta combinación híbrida, prendes la luz y se produce oxígeno, porque las algas lo hacen mediante la fotosíntesis. Imagina que tienes una herida y te ponen la piel sintética tradicional. Tus células deberían repoblar este tejido biodegradable, pero en muchas ocasiones esto no ocurre porque el oxígeno es incapaz de llegar a la zona que se está regenerando. A esta piel artificial nosotros le incorporamos algas para que produzca oxígeno en la herida.
¿Qué aplicaciones podría tener esta tecnología?
Además de favorecer la regeneración de tejidos, podría utilizarse en muchos otros escenarios clínicos como el tratamiento de tumores o el trasplante de órganos. El objetivo final es que donde se necesite oxígeno, lo puedas producir independiente de lo que ocurra con el sistema cardiovascular. También estamos haciendo materiales fotosintéticos que, además de oxígeno, producen otras cosas en base a la luz. Una de las formas de hacerlo es modificar genéticamente las algas para que liberen lo que necesitas: antibióticos,antiinflamatorios o moléculas que inducen el crecimiento de vasos sanguíneos, por ejemplo.
Lo que se viene
Los avances de la investigación han continuado y Egaña proyecta los próximos pasos de la investigación. Hasta ahora, el tejido fotosintético ha sido probado en modelos de ratón con resultados exitosos. Sin embargo, antes de llegar a las pruebas con humanos, falta un trayecto.
¿Cuál es la siguiente etapa de investigación?
En 2013 fundamos SymbiOx Inc. en California, que es una empresa que tiene como objetivo acelerar el proceso de investigación y desarrollo de HULK. Con ese equipo ganamos un proyecto CORFO que nos va a permitir trabajar en varios objetivos. Por una parte, validar los resultados que hemos obtenido en un modelo porcino. Por otra, evaluar el potencial regenerativo de algas autóctonas de Chile y desarrollar vendajes que emitan luz directo en las heridas.
El camino por recorrer todavía es largo. Como bien lo resume él: “Todavía hay muchas preguntas por responder”.
Fuente: Revista “Chile tiene su Ciencia”, mayo de 2015.



Deja un comentario